Wenn Sie dieses tägliche Medikament verwenden, hat die FDA eine dringende neue Warnung

Jeder, der mit einem chronischen Gesundheitszustand lebt, hat wahrscheinlich eine tägliche Medikamentenroutine. Glücklicherweise gibt es Produkte, die die Symptome lindern, dazu beitragen können, große gesundheitliche Notfälle zu vermeiden und es zu ermöglichen, ein relativ normales Leben zu führen. Jetzt hat die Food & Drug Administration (FDA) eine Warnung für ein tägliches Medikament herausgegeben, von dem Sie vielleicht wissen möchten. Lesen Sie weiter, um zu sehen, welches Produkt aufgrund eines potenziellen Gesundheitsrisikos gezogen wird.
Verwandte: Diese häufigen Sodbrennen und Schmerzmittel wurden nur zurückgerufen, warnt die FDA.
Mylan Pharmaceuticals hat einen freiwilligen Rückruf einer Charge seiner Insulinglargin -Injektion herausgegeben.
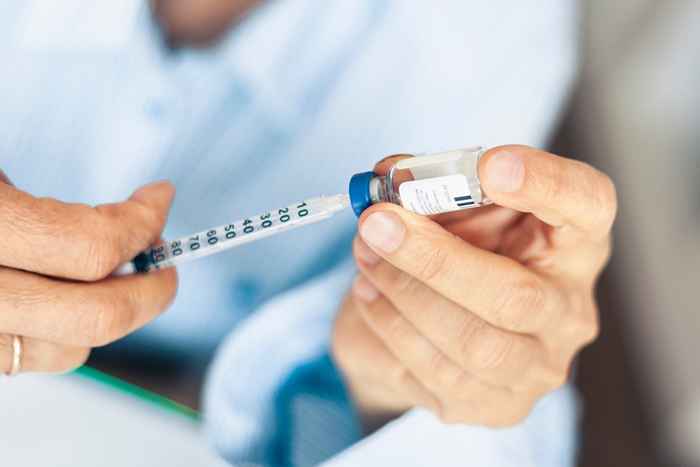
Am 12. April gab die FDA bekannt, dass Mylan Pharmaceuticals Inc. erinnert freiwillig eine Charge seiner Insulinglargin-Injektion (Insulin Glargine-Yfgn), 100 Einheiten/ml (U-100). Das Produkt ist in 10 ml Fläschchen verpackt, die in einem Karton verpackt sind. Mylan Specialty l.P. verteilt die betroffenen Produkte in der U.S. Zwischen dem 9. Dezember 2021 und dem 4. März 2022.
Rückrufelemente können durch die NDC-Nummer 49502-393-80, die Batchnummer BF21002800 und das Ablaufdatum von August identifiziert werden. 2023 auf dem Karton gedruckt, in dem es versandt wurde. Darüber hinaus gibt die Mitteilung fest, dass der Rückruf das ungebrandige Insulin-Glargine-YFGN-Fläschchen beeinflusst und nicht die Marken-Austauschbar.
Das Insulin wird aufgrund fehlender Etiketten in einigen Fläschchen zurückgerufen.

Der Mitteilung zufolge hat Mylan Pharmaceuticals den Insulin -Rückruf herausgegeben, nachdem er festgestellt hatte. Dies könnte ein potenzielles Gesundheitsrisiko für Erwachsene und Kinder mit Typ 1 und Typ -2 -Diabetes schaffen, die das Medikament täglich verwenden, um die glykämische Kontrolle zu verbessern. AE0FCC31AE342FD3A1346EBB1F342FCB
"Für Patienten, die mit mehr als einer Art Insulin behandelt werden (e).G., Sowohl kurzes als auch langwirksames Insulin), ein fehlendes Etikett für Insulinglarginfläschchen, könnte zu einer Verwechslung von Produkten/Stärken führen, was zu einer geringeren optimalen glykämischen Kontrolle (entweder hoher oder niedriger Blutzucker) führen kann, was zu schwerwiegenden Komplikationen führen kann "Die FDA warnt.
Verwandte: Weitere Informationen finden Sie in unserem täglichen Newsletter.
Hier ist, was medizinische Versorgung Großhändler und Einzelhändler tun sollten, wenn sie die zurückgerufenen Fläschchen haben.

Die FDA rät allen Einzelhändlern, ihr Inventar zu prüfen, um sofort nach dem zurückgerufenen Produkt zu suchen. Wenn eine gefunden wird, unter Quarantäne stellen und die Verteilung der Charge einstellen.
Die medizinische Versorgung mit Großhändlern sollte auch ihre Inventar-, Quarantäne- und Verteilung des zurückgerufenen Produkts untersuchen und einstellen. Sie sollten dann alle Kunden aufmerksam machen, die das zurückgerufene Produkt erhalten haben, einschließlich Einzelhandelskunden. Eine Liste aller potenziellen Käufer des zurückgerufenen Produkts sollte ebenfalls in eine Liste in einer Microsoft Excel -Datei aufgenommen und innerhalb von fünf Werktagen per E -Mail an [E -Mail geschützt] gesendet werden. Sedgwick (Stericycle) verwendet diese Informationen, um Ihre Kunden auf Einzelhandelsebene zu informieren, die die betroffene Stapel erhalten haben.
Kunden mit zurückgerufenen Fläschchen sollten Stericycle für ein Rückgabepaket anrufen.

Glücklicherweise wurden nach Angaben der FDA noch keine negativen medizinischen Ereignisse im Zusammenhang mit dem Rückruf gemeldet. Kunden, die in ihrem Besitz nicht veröffentlicht haben, sollten jedoch Stericycle unter 1-888-912-7084 anrufen, um ein Dokumentationspaket anzufordern, um das Produkt an das Unternehmen zurückzugeben.
Für allgemeine Fragen zum Rückruf können Kunden an Wochentagen ab 8 A die Kundenbeziehungs-Hotline für Viutris unter 1-800-796-9526 anrufen.M. bis 5 p.M. EST oder senden Sie eine E -Mail an [E -Mail geschützt]. Die Agentur berät auch jedem, der möglicherweise Gesundheitsprobleme aufgetreten ist.
Verwandte: Wenn Sie eines dieser 7 Medikamente haben, hören Sie jetzt auf, sie zu verwenden, da die FDA warn.


