Dieses Medikament wird sofort wirksam erinnert, warnt die FDA
Wenn ein medizinischer Hersteller freiwillig ein Medikament erinnert, kann die Wahrscheinlichkeit von nachteiligen Wirkungen statistisch niedrig sein. Wenn jedoch Verletzungen durch zurückgerufene Medikamente auftreten, können sie ernst sein und sogar lebensbedrohlich sein. Lesen Sie weiter, um zu erfahren, welches Medikament derzeit in den Vereinigten Staaten zurückgerufen wird und was zu tun ist, wenn Sie glauben, dass Sie es möglicherweise als Patient begegnet haben.
Verwandte: Wenn Sie über 60 sind, nehmen Sie diese OTC -Medikamente nicht jeden Tag, sagen Beamte.
B. Braun Medical erinnert an fünf viele 0.9% Natriumchlorid zur Injektion USP 250 ml im Umlauf um die U.S.

B. Braun Medical Inc. erinnert sich freiwillig an fünf viele 0.9% Natriumchlorid zur Injektion USP 250 ml in Excel innerhalb der USA. Krankenhäuser und Konsumenten haben dieses Medikament bereits in der Hand, nachdem es im ganzen Land an inländische Händler verteilt wurde.S. Food & Drug Administration (FDA) Website. AE0FCC31AE342FD3A1346EBB1F342FCB
Das Unternehmen kündigte den Rückruf auf mar an. 2 und die FDA veröffentlichten die Mitteilung über Mar. 3; Dieser Rückruf wird mit dem Wissen der FDA durchgeführt. Zurückgezogene Lose umfassen J1E086, J1E204, J1E213, J1H137 und J1H138, die alle im Mai oder Juni 2022 nach Ablaufdaten verfügen.
Das Medikament hat verschiedene Anwendungen in Bezug auf Hydratation und Bluttransfusionen.
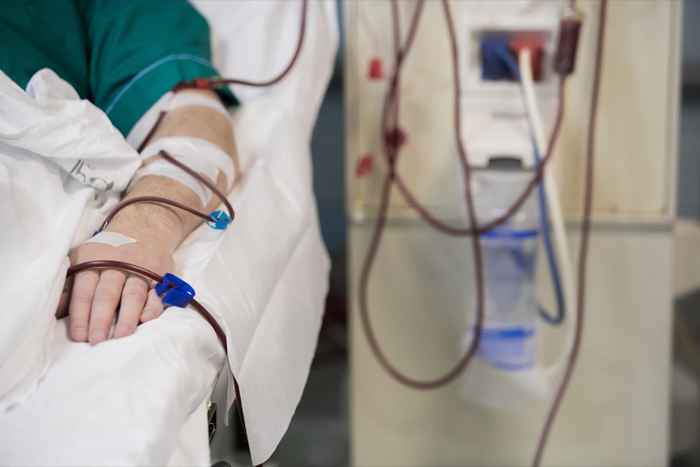
Diese intravenösen Lösungen sind für die Verwendung bei Erwachsenen und Kindern als Elektrolyte- und Wasserquellen für die Flüssigkeitszufuhr angezeigt. Insbesondere ist dieses Arzneimittel für "extrazellulärer Flüssigkeitsersatz, die Behandlung der metabolischen Alkalose in Gegenwart von Flüssigkeitsverlust und leichte Natriumverarmung angezeigt". Die 0.9% Natriumchlorid -Injektion USP in Excel ist auch für die Verwendung als Priming -Lösung bei Hämodialyseverfahren angezeigt und kann verwendet werden, um Bluttransfusionen ohne Hämolität roter Blutkörperchen zu initiieren und zu beenden.
Verwandte: Für die neuesten Rückrufnachrichten, die direkt in Ihren Posteingang geliefert wurden, melden Sie sich für unseren Daily Newsletter an.
Der Grund für den Rückruf ist die und unzureichende Flüssigkeit.

Das Unternehmen initiierte den freiwilligen Rückruf aufgrund von Flüssigkeitsleckagen oder einem niedrigen Füllvolumen innerhalb der Behälter. "Das größte Risiko mit einem langsamen Leck bei einer intravenösen Lösungsvorbereitung ist eine Sterilität, die ein Risiko darstellt, dass der Patient einer bakteriellen oder einer Pilzinfektion ausgesetzt ist". Und obwohl die Wahrscheinlichkeit, dass es geschieht, fern ist, könnte das Problem zu einer Blutkreislaufinfektion führen. Zum Glück jedoch b. Braun hat in dieser Phase keine Berichte über unerwünschte Ereignisse im Zusammenhang mit diesem Rückruf erhalten.
Folgendes sollten Sie tun, wenn Sie möglicherweise das zurückgerufene Medikament und die nachteiligen Wirkungen erhalten haben.

Das Unternehmen benachrichtigt seine Händler und Kunden über eine offizielle Rückrufbescheid, die als zertifizierter maileiner Mail gesendet wurde, und organisiert die Rückgabe aller zurückgerufenen Produkte. Alle Einrichtungen und Händler, die Produkte auf Lager haben. Braun Medical Inc. Kundendienstabteilung unter 800-227-2862 Montag bis Freitag, 8 a.M. bis 6 p.M. EST, um die Produktrendite zu arrangieren.
Wenn Sie Fragen zum Rückruf haben, wenden Sie sich an B. Braun telefonisch während derselben Geschäftszeiten. Wenn Sie ein Patient sind, der der Meinung ist, dass Sie möglicherweise Probleme im Zusammenhang mit diesem Medikament hatten, werden Sie empfohlen, Ihren Arzt oder Gesundheitsdienstleister zu kontaktieren.
Darüber hinaus können unerwünschte Reaktionen oder Qualitätsprobleme, die bei der Verwendung dieses Produkts auftreten. Weitere Berichtsoptionen umfassen reguläre Mail oder Fax, die beide mit dem Herunterladen dieses Berichtsformulars beginnen. Vervollständigen Sie es und kehren Sie zur Adresse des voradressierten Formulars zurück oder senden Sie sie per Fax an 1-800-FDA-0178.
Verwandte: Verwenden Sie dieses gemeinsame Medikament niemals länger als eine Woche, warnen Experten.


