4 Medikamente Ärzte werden nie wieder verschreiben

Wenn Sie Ihre Gesundheit einem Arzt anvertrauen, denken Sie vielleicht, dass Sie beide die einzigen Parteien sind, die entscheidende Anrufe über Ihr Wellness machen. In dem zweiten, der Ihr Arzt ein verschreibungspflichtiges Pad herausnimmt, wird dieser Vertrauenskreis um Pharmaunternehmen und Aufsichtsbehörden erweitert. Leider macht die Pharmaindustrie leider, wie wir alle aus hochkarätigen Rückrufen, in denen Medikamente vom Markt genommen werden. Während alle Medikamente mit Risiken und Vorteilen ausgestattet sind, haben sich bestimmte Produkte als zu gefährlich erwiesen, um vermeidbar und irreversibler zu schaden oder sogar zu Tod.
Inzwischen bleiben viele Medikamente mit schwerwiegenden Nebenwirkungen auf dem Markt oder kehren nach einem kurzen Rückruf zurück. Es dauert viel, bis Drogen dauerhaft aus den Regalen gezogen werden, aber es passiert es. Lesen Sie weiter, um über vier Medikamenten zu erfahren, die Ärzte wahrscheinlich nie wieder verschreiben werden, und um die überraschenden Geschichten darüber zu hören, warum sie nicht mehr verschrieben werden.
Lesen Sie dies als nächstes: Große Apotheken blockieren dieses gemeinsame tägliche Medikament.
1 Vixx für Arthritis

Vioxx ist ein COX-2-Inhibitor, der einst häufig zur Behandlung von Arthritis eingesetzt wurde. Aber im Jahr 2004 der Hersteller des Arzneimittels, Merck & Co., Hatte es den Markt genommen, als die Nachricht brach, dass es zwischen 1999 und 2003-38.000 mit 88.000 Herzinfarkten in Verbindung gebracht worden war, von denen tödlich waren. Als es aus dem Markt gezogen wurde, wurde geschätzt, dass über 20 Millionen Patienten das Medikament eingenommen hatten. 2007 erreichte Merck eine 4.85 Milliarden Dollar Siedlung zur Lösung von Tausenden von Klagen-die größte Drogensiedlung in der Geschichte, so NPR.
"Es besteht sicherlich einen Bedarf an Cox-2 William Soliman, PhD, BCMAS, Gründer und CEO des Akkreditierungsrates für medizinische Angelegenheiten (ACMA) und eine pharmazeutische Führungskraft, die zuvor mit Merck zusammengearbeitet hat. "Meiner Meinung nach führte dies zu einigen kardiovaskulären Risiken", erzählt Soliman Bestes Leben.
2 Bextra zur Schmerzlinderung

Valdecoxib, als Bextra bezeichnet, ist ein nichtsteroidales entzündungshemmendes Medikament (NSAID), das einst als Schmerzmittel verschrieben wurde. Im Jahr 2005 erfuhren die Forscher jedoch, dass das Medikament schwerwiegende und manchmal tödliche kardiovaskuläre Komplikationen wie Herzinfarkt und Schlaganfall verursachte. Selten wurde festgestellt, dass Bextra zwei potenziell tödliche Hautreaktionen verursacht.
Nachdem er festgestellt hatte, dass Bextra keinen besonderen Vorteil gegenüber ähnlichen Schmerzmittel hatte, die keine so schwerwiegenden Komplikationen verursachten, beantragte die FDA, ihre Verwendung einzustellen.
3 Belviq für Gewichtsverlust

Lorcaserin, als Belviq oder Belviq XR gebrandmarkt, wurde zuvor nach der Genehmigung im Jahr 2012 als Gewichtsverlustmedikament verschrieben. Im Jahr 2020 wies die FDA die Ärzte jedoch an, Lorcaserin zu verschreiben, nachdem eine Studie einen Zusammenhang zwischen Medikamenten und Krebs ergab. AE0FCC31AE342FD3A1346EBB1F342FCB
"Wir ergreifen diese Maßnahmen, weil wir glauben, dass die Risiken von Lorcaserin ihre Vorteile auf der Grundlage unserer abgeschlossenen Überprüfung der Ergebnisse einer randomisierten klinischen Studie zur Bewertung der Sicherheit". "Angehörige der Gesundheitsberufe sollten die Verschreibung und Abgabe von Lorcaserin an Patienten aufhören. Wenden Sie sich an Patienten, die derzeit Lorcaserin einnehmen, sie über das verstärkte Auftreten von Krebs in der klinischen Studie informieren, und bitten Sie sie, die Einnahme der Medikamente zu beenden. Besprechen Sie alternative Gewichtsverlustmedikamente oder Strategien mit Ihren Patienten ".
Weitere Gesundheitsnachrichten, die direkt in Ihren Posteingang gesendet werden, melden Sie sich für unseren Daily Newsletter an.
4 Raptiva für Psoriasis
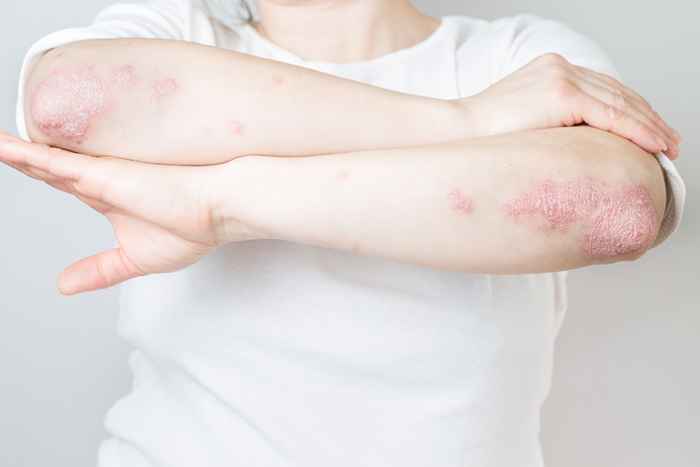
Efalizumab, als Raptiva bezeichnet, war ein einst wöchentlich injizierbares Medikament zur Behandlung von Erwachsenen mit mittelschwerer bis schwerer Plaque-Psoriasis. Im Jahr 2009 startete sein Produzent jedoch "einen freiwilligen, schrittweisen Rückzug des Produkts aus dem U.S. Markt."
Dies liegt daran. In seiner Notfallentzugsbekanntmachung stellte die FDA fest, dass es "keine bekannte wirksame Behandlung für PML" gibt, und obwohl es für eine Person, die Raptiva zur Entwicklung der Krankheit einnimmt.
Das beste Leben bietet die aktuellsten Informationen von Top-Experten, neuen Forschungen und Gesundheitsbehörden, aber unsere Inhalte sind nicht als Ersatz für berufliche Anleitung gedacht. Wenn es um die Medikamente geht, die Sie einnehmen oder andere gesundheitliche Fragen, die Sie haben, wenden Sie sich immer direkt an Ihren Gesundheitsdienstleister.


